Creutz-Taube majmuasi - Creutz–Taube complex
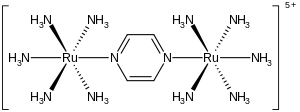
The Creutz-Taube ioni bo'ladi metall kompleksi formula bilan [[Ru (NH3 )5]2(C4H4N2)}5+. Ushbu kationik tur samimiy tafsilotlarni tushunish maqsadida juda ko'p o'rganilgan ichki sfera elektronlarini o'tkazish, ya'ni qanday qilib elektronlar bir metall kompleksidan boshqasiga o'tish. Ion nomi bilan atalgan Kerol Kreyts birinchi bo'lib kim majmuani tayyorlagan va uning tezis bo'yicha maslahatchisi Genri Taube, kim olgan Kimyo bo'yicha Nobel mukofoti bu va shunga o'xshash kashfiyotlar uchun elektron o'tkazish.[1][2]
Xususiyatlari
Kompleks ikkitadan iborat pentamminruteniy ko'prikdagi azot atomlari bilan bog'langan birliklar pirazin ligand, bu oktahedralni yakunlaydi muvofiqlashtirish sohasi har bir metalldan. Murakkablikning muhim xususiyati shundaki, ikkala metalning fraksional oksidlanish darajasi +2,5 ga teng. Odatda metall ionlari, aksariyat ionlar singari, ajralmas oksidlanish darajalariga ega. Masalan, ruteniyum ammin komplekslari odatda +2 yoki +3 ga teng. Oksidlanish darajalarining yarim integral ekanligi ikkala Ru (NH) ekanligini ko'rsatadi3)5 elektronlar soni bo'yicha markazlar tengdir. Kristalografik va nazariy tadqiqotlar ushbu tavsifga mos keladi, ya'ni ikkita metall markazlari tengdir.[3][4] Aralash valentlik kompleksiga xos bo'lgan ushbu ion nurlanishni infraqizilga yaqin qismida kuchli singdiradi elektromagnit spektr. Kreyts-Taube ionida maksimal yutilish 1570 ga to'g'ri keladinm. Ushbu singdirish an intervalli zaryad uzatish tasmasi.
Sintez
Ion dastlab gidratlangan holda ajratilgan tosilat tuz [Ru (NH3)5]2(C4H4N2) (O3SC6H4CH3)5· 3H2O. Ru (III) -Ru (III) pirazin kompleksi orqali ikki bosqichda tayyorlanadi:.[3]
- 2 [Ru (NH.)3)5Cl]2+ + C4H4N2 → {[Ru (NH.)3)5]2(C4H4N2)}6+ + 2 Cl−
- 2 {[Ru (NH.)3)5]2(C4H4N2)}6+ + Zn → 2 {Ru (NH3)5]2(C4H4N2)}5+ + Zn2+
Creutz-Taube ioni oksidlanish-qaytarilish reaktsiyalarini o'rganish uchun ruteniyum komplekslarining afzalliklarini aks ettiradi. Ru (II) va Ru (III) ionlari ozaro almashinishi mumkin oksidlanish-qaytarilish potentsiali. Ushbu ikkala oksidlanish darajasi kinetik jihatdan inertdir. Ushbu ionning ko'plab analoglari turli xil ko'prikli ligandlar yordamida tayyorlangan.
Adabiyotlar
- ^ Kreyts, C .; Taube, H. (1969). "Metall ionlar orasidagi elektron o'tkazishda Frank-Kondon to'sig'ini o'lchash bo'yicha to'g'ridan-to'g'ri yondashuv". Amerika Kimyo Jamiyati jurnali. 91: 3988–3989. doi:10.1021 / ja01042a072.
- ^ Taube, Genri (1983 yil 8-dekabr). "Metall majmualar o'rtasida elektron o'tkazish" (PDF). Nobel ma'ruzasi.
- ^ a b Fyurxolz, U .; Joss, S .; Burgi, H. B.; Ludi, A. (1985). "Kreyts-Taube majmuasi qayta ko'rib chiqildi: elektron-uzatish seriyasini kristalografik o'rganish (m-pirazin) dekamamminedirutenium ([(NH.)3)5Ru (Pyz) Ru (NH3)5]n+ (n = 4–6))". Anorganik kimyo. 24: 943–948. doi:10.1021 / ic00200a028.
- ^ Demadis, K. D .; Xarthorn, C. M.; T. J., Meyer (2001). "Aralash valentli kimyoda lokalizatsiya qilingan-delokalizatsiya qilingan o'tish". Kimyoviy sharhlar. 101 (9): 2655–2686. doi:10.1021 / cr990413m.
