Yashil-Devies-Mingos qoidalari - Green–Davies–Mingos rules
Yilda organometalik kimyo, Yashil-Devies-Mingos qoidalari bashorat qilish regiokimyo uchun nukleofil qo'shilishi 18 elektrongacha metall komplekslari tarkibida bir nechta to'yinmagan ligandlar.[1] Qoidalar 1978 yilda organometalik kimyogarlar tomonidan nashr etilgan Stiven G. Devis, Malkolm Yashil va Maykl Mingos. Ular to'yinmagan uglevodorodning qanday va qayerda ko'proq sezgir bo'lishini tasvirlaydi nukleofil hujum murakkablashganda.[1]
1-qoida
Nukleofil hujumi juft raqamli polienlarga (hatto umidsizlik ).[1]

2-qoida
Nukleofillar tsiklik polienlarga emas, balki asiklik polenlarga qo'shiladi.[1]

3-qoida
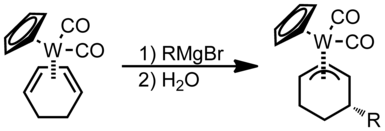
Nukleofillar imtiyozli ravishda terminali bo'yicha juftlikli polien ligandlarni qo'shadilar.[1]Nukleofillar, agar metall yuqori darajada elektrofil bo'lsa, terminal holatida toq-hapsitik asiklik polen ligandlarini qo'shadi, aks holda ular ichki maydonga qo'shiladi.
Soddalashtirilgan: hatto toq oldin va yopilishidan oldin ochiq
Quyida juft / toq gapticity va ochiq / yopiq b-ligandlarning reaktivlik tendentsiyalari ko'rsatilgan diagramma berilgan.
Metall markaz elektronni tortib oladi. Metall karbonilga ham biriktirilgan bo'lsa, bu ta'sir kuchayadi. Elektronning kambag'al metallari karbonil bilan yaxshi bog'lanmaydi. Metallni tortib oladigan elektron qancha ko'p bo'lsa, CO ligand shuncha ko'p bog'lanish xususiyatiga ega. Bu ligandga yuqori kuch doimiyligini beradi. Bog'langan karbonil uchun topilgan natijaviy kuch konstantasi, agar ular bir xil kompleksdagi CO ligandini almashtirgan bo'lsa, b ligandlar uchun bir xil kuch doimiyligini anglatadi.
Agar kCO * (CO ligandiga ta'sir etuvchi kuch konstantasi) chegara qiymatidan past bo'lsa, nukleofil qo'shilishi bo'lmaydi. [2]
Quyidagi rasmda karbonil guruhiga biriktirilgan bog'langan metall ko'rsatilgan. Ushbu guruh qisman musbat zaryadga ega va shuning uchun nukleofil hujumga moyil. Agar L bilan ifodalangan ligand bo'lsan b-ligand bo'lsa, u ham nukleofil hujumiga qarab faollashadi.
Kiruvchi nukleofil hujumi quyidagi rasmdagi b-tizim terminalaridan birida sodir bo'ladi:
Ushbu misolda halqa tizimini 1,3-butadienga o'xshash deb hisoblash mumkin. Yashil-Devies-Mingos qoidalariga rioya qilgan holda, butadien teng gaptitikaning ochiq b-ligandidir, nukleofil hujum b-tizimining terminal holatlaridan birida sodir bo'ladi. Bu butadienning LUMO ichki pozitsiyalaridan ko'ra uchlarida kattaroq loblarga ega bo'lganligi sababli sodir bo'ladi.
Komplekslarga misollar
Quyida b-ligandlarning uch turini o'z ichiga olgan kompleksga misol keltirilgan bo'lib, b-tizimlaridan biriga nukleofilning imtiyozli hujumini namoyish etadi.

Yuqoridagi kompleks uch turdagi b-ligandlarni o'z ichiga oladi. Siklooktan halqasida chapda butadien bo'lagi, o'ngda allil bo'lagi mavjud. Kobalt markazidagi siklopentadien ligand uchinchi turini beradi.
Siyanid nukleofilining hujumi afzalroq butadien fragmentining uchida sodir bo'ladi. (Yuqoridagi rasmda noto'g'ri mahsulot ko'rsatilgan)
Yuqorida keltirilgan qoidalarga rioya qilgan holda butadien fragmenti alpl fragmentiga qaraganda katta reaktivlikka ega bo'lgan, tekis gaptsitlikning ochiq ligandidir, toq gaptikalikning ochiq ligandiga yoki tsiklopentadienga, toq gaptitikaning yopiq ligandiga ega.
Hujum terminalda sodir bo'ladi, natijada konjuge mahsulot ko'rsatiladi.
Ichki hujum
Bu erda allaqachon metallga biriktirilgan ligand nukleofil vazifasini bajaradi va ichki metall markazga hujum qiladi.[3][4]

Hujum regiokimyosiga ligandlar turlarining ta'siri
Terminal holatidagi nukleofil hujum allil qachon ligandlar lig ligandni qabul qilish mavjud.[5]
Agar sigma beradigan ligandlar mavjud bo'lsa, ular ligandga elektronlarni quyishadi va hujum ichki holatida sodir bo'ladi.

Asimmetrik ligandlarning ta'siri
Asimmetrik allil ligandlar mavjud bo'lganda, hujum o'rnini bosgan holatda sodir bo'ladi.[6]

Bu holda hujum uglerodga ikkala R guruhi biriktirilgan holda sodir bo'ladi, chunki bu o'rnini egallagan holat.
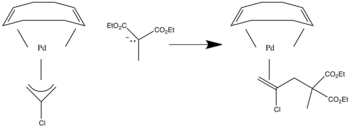
Katta l ligandlarning ta'siri
Katta π ligandlar bo'lganda [7] mavjud bo'lib, ular turli xil nukleofil hujumlarga uchrashi mumkin. Quyidagi rasmda nukleofil xujum yuqoridan yoki pastdan sodir bo'lishi va er-xotin bog'lanishni kamaytirishi va nukleofil qo'shilishi mumkin.

Ushbu nukleofil hujum yuqori yoki pastki qismlarda ham bo'lishi mumkin va nukleofilni qo'shishi mumkin.
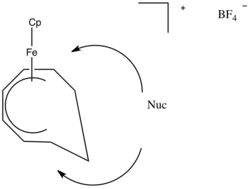
Sintezda ishlatiladi
B ligandlarga nukleofil qo'shilishi sintezda ishlatilishi mumkin. Buning bir misoli tsiklik metall birikmalarini yaratishdir.[8] Nukleofillar b ligand markaziga qo'shilib, metallobutan hosil qiladi.


Adabiyotlar
- ^ a b v d e Devies, Stepehn G.; Yashil, Malkolm L. H.; Mingos, D. Maykl P. (1978). "Tarkibida to'yinmagan uglevodorod ligandlari bo'lgan organotransition metal kationlariga nukleofil qo'shilishi: tadqiqot va talqin". Tetraedr. 34 (20): 3047–3077. doi:10.1016 / 0040-4020 (78) 87001-X.
- ^ Bush Rassell S.; Anjelici Robert J. (1986). "Metall karbonil νCO b-etilen va b-benzol kompleksining nukleofillar bilan reaktivligini taxmin qiluvchi kuch barqarorlari ". Amerika Kimyo Jamiyati jurnali. 108 (10): 2735–2742. doi:10.1021 / ja00270a037.
- ^ Periana Roy A .; Bergman Robert G. (1984). "Gidrido (siklopropil) rodyum kompleksini radaatsiklobutanga tezda molekula ichidagi qayta tashkil etish. Kationli rodyum b-allil kompleksining markaziy uglerod atomiga gidrid qo'shilishi bilan metallatsiklning mustaqil sintezi". Amerika Kimyo Jamiyati jurnali. 106 (23): 7272–7273. doi:10.1021 / ja00335a084.
- ^ Suzuki, Tomohiro; Okada, Goro; Xioki, Yasunori; Fujimoto, Xiroshi (2003). "(B-allil) molibden komplekslarining reaktivligini nazariy o'rganish". Organometalik. 22 (18): 3649–3658. doi:10.1021 / om0207459.
- ^ Aranyos, Attila; Sabo, Kalman J.; Kastino, Ana M.; Bekval, Yan-E. (1997). "(B-allil) paladyum komplekslariga nukleofil qo'shilishidagi markaziy va terminal hujumi. Ligand effektlari va mexanizmi". Organometalik. 16 (5): 1058–1064. doi:10.1021 / om960950m.
- ^ Delbek, F .; Lapouge, C. (2000). "(N.) Ga nukleofil qo'shimchasining regioselektivligi3-allil) Paladyum majmualari. Nazariy tadqiqotlar. Organometalik. 19 (14): 2716–2723. doi:10.1021 / om0003032.
- ^ Shyorshusen, Sonya; Xek, Yurgen (2007). "Siklooktatetrenning yangi metilen-ko'prikli, bisiklik birikmalarga metalli vositasida o'tkazilishi". Organometalik. 26 (22): 5386–5394. doi:10.1021 / om700539e.
- ^ Periana, Roy A (1986). "Sikloalkilgidridorodiy komplekslarini ratsatsikloalkanlarga joylashtirish orqali uglerod-uglerodli faollashuv. Uchinchi darajali metall-uglerod bog'lanishiga ega metallatsiklobutanlarni sintez qilish, b-allil komplekslariga nukleofil qo'shilishi bilan". Amerika Kimyo Jamiyati jurnali. 108 (23): 7346–7355. doi:10.1021 / ja00283a033.