N-asetilglukozamin-6-fosfat deatsetilaza - N-acetylglucosamine-6-phosphate deacetylase
| Mycobacterium smegmatis tarkibidagi N-asetilglukozamin-6-fosfat deatsetilaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 3.5.1.25 | ||||||||
| CAS raqami | 9027-50-3 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
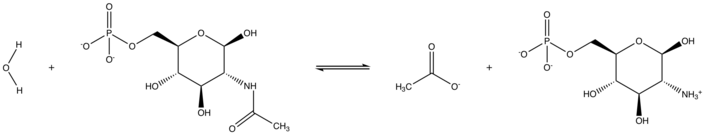
Yilda enzimologiya, N-asetilglukozamin-6-fosfat deatsetilaza (EC 3.5.1.25 ), shuningdek GlcNAc-6-fosfat deatsetilaza yoki NagA sifatida tanilgan, an ferment bu kataliz qiladi deatsetilatsiya glyukozamin-6-fosfat (GlcN-6-P) gacha bo'lgan N-asetilglukozamin-6-fosfat (GlcNAc-6-P):
- H2O + N-asetil-D-glyukozamin 6-fosfat asetat + D-glyukozamin 6-fosfat[1]
GlcNAc-6-fosfat deatsetilaza NagA geni bilan kodlangan.[2]
Ushbu ferment amidohidrolaza superfamily.[3] Amidohidrolazalar - bu bir turi gidrolaza bu amid obligatsiyalariga ta'sir qiladi. Amidohidrolaza oilasining barcha a'zolari a TIM bochkasi tuzilishga ega va a'zolarning katta qismi metallofermentlar.[4] Fermentlar oilasi aminokislota va nukleotid almashinuvida hamda qishloq xo'jaligi va sanoat birikmalarining biologik parchalanishida muhim ahamiyatga ega. NagA amino-shakar almashinuvida, xususan aminokiser-nukleotidlarning biosintezida qatnashadi.[5]
Tuzilishi
NagA - bu strukturaning har bir dimerida ikkita domenga ega bo'lgan gomodimerik ferment.[6] Men har bir domenni o'z ichiga oladi (β / a)8 - TIM bochkasi deb ham ataladigan bochkaning strukturaviy burmasi va fermentning faol joyini o'z ichiga oladi. Har bir faol uchastka navbati bilan substrat va metall ko-faktorini aniqlashda ishtirok etadigan fermentning katalitik joyidan va metallni bog'laydigan joydan iborat. Shuningdek, I domeni qo'shni subbirlikning I domeni bilan dimerik interfeysni hosil qiladi.[6] NagA fermentlarining kichikroq ikkinchi domeni fermentni barqarorlashtirish uchun potentsial ta'sir ko'rsatadigan b-barrelni o'z ichiga oladi.[6] Amidohidrolazning barcha a'zolari TIM-barrel strukturaviy katlamini ishlatganda, NagA in Escherichia coli (EcNagA) fermentning huni kabi katalitik uchastkasini o'rab turgan psevdo-TIM bochkasiga ega.[7] NagA ning dimer tuzilishi fermentning faolligi va termostabilligi uchun hal qiluvchi hisoblanadi.[8]

Metall bog'laydigan joy
Amidohidrolaza fermentlari faol uchastkada bitta, ikkita yoki uchta metall atomlarini bog'lashi mumkin. Ushbu metallarga Zn kirishi mumkin2+, Co2+, Fe2+, CD2+va boshqalar.[1] EcNagA tarkibida Zn bo'lgan bir yadroli metall bilan bog'lanish joyi mavjud2+ ion;[3] bundan tashqari, EcNagA metall bilan bog'lanish joyida bog'langan fosfat ionini ko'rsatadi.[7] EcNagA dan farqli o'laroq, NagA of Mikobakteriya smegmatis (MSNagA) va Bacillus subtilis (BsNagA) binuclear metall bilan bog'lanish joylariga ega. MSNagA har bir faol uchastkada joylashgan ikkita ikki valentli metall ioniga ega, ular ham samarali kataliz va ham strukturaviy barqarorlik uchun zarurdir.[6] Ko'pgina boshqa bakteriyalar turlari Znni o'zlarining metall koeffitsienti sifatida ishlatsa, BsNagA temirni metall bilan bog'lanish joyida ustun metall sifatida ishlatadi.[9]
Katalitik bilan bog'laydigan joy
EcNagA va BsNagA-ning faol sayt qoldiqlarining aksariyati konservalangan va shu kabi tarkibiy pozitsiyalarga ega. Mikobakterial NagA fermentlari va boshqa bakteriyalar turlaridan NagA fermentlari o'rtasidagi farq 131-pozitsiyada sistein borligidir. Boshqa bakteriyalar turlari bu holatda lizin qoldig'iga ega. Ushbu sistein moslashuvchan tsiklda joylashgan bo'lib, bu fiziologik substratning bog'lanishiga to'sqinlik qiladi.[6]
Mexanizm
Taklif qilingan NagA fermentlari uchun katalitik mexanizm metall bilan muvofiqlashtirilgan suv molekulasi yoki gidroksid ioni orqali nukleofil hujumidan foydalanadi. Mexanizm, substratning karbonil guruhiga hujum qilish uchun dastlab gidrolitik suv molekulasini faollashtirish uchun asos bo'lib xizmat qiladigan qat'iy saqlanadigan aspartik kislota qoldig'i (Asp-273) orqali ishlaydi.[3] Keyin Asp-273 kislota vazifasini o'tab, aminni tark etuvchi guruhga proton hosil qiladi. BsNagA va uning metall bilan bog'lanish joyidagi ikkita temir koeffitsientidan foydalangan holda taklif qilingan mexanizmlardan biri Fe-ko'prikli gidroksid bilan nukleofil hujumini va keyin ikki Fe atomining biri tomonidan karbonil kislorodning stabillashishini namoyish etadi.[9]
Biologik funktsiya

NagA hujayraning sitoplazmasida joylashgan. N-asetilglukozamin (GlcNAc) hujayra devorining parchalanishi doirasida hujayraga kiradi. Monosaxarid va glyukoza hosilasi bo'lgan GlcNAc bakteriyalar hujayrasi devoridagi biopolimerning bir qismidir. Ushbu biopolimer qatlamli strukturani hosil qiladi peptidoglikan (PG). Keyin GlcNAc NagE fermenti tomonidan GlcNAc-6-P ga aylanadi.[10] Keyinchalik, bu substrat asetat va GlcN-6-P ga deatsetillanadi, NagA tomonidan.[11] NagA GlcN-6-P ishlab chiqarish uchun muhimdir, keyinchalik u ikkita asosiy yo'lda ishlatiladi: PGni qayta ishlash yo'li va glikoliz yo'l.
PGni qayta ishlash yo'li
PGni qayta ishlash yo'lida GlcNAc-6-P NagA bilan metabollangandan so'ng, uning mahsuloti GlcN-6-P GlmM fermenti bilan GlcN-1-P ga aylantirilishi mumkin, so'ngra reetetilatsiya va UTP bilan GlmU tomonidan reaksiya UDP-GlcNAc hosil qilish uchun.[10][11] UDP-GlcNAc bu yo'lning yakuniy mahsulotidir, undan keyin uni yaratish uchun foydalaniladi glikozaminoglikanlar, proteoglikanlar va glikolipidlar hujayra devori uchun PGni to'ldirish uchun zarur bo'lgan barcha narsalar.[12] PGni qayta ishlash bakteriyalar o'sishini ta'minlash va oldini olish uchun bakteriyalar hujayralari uchun zarurdir hujayra lizisi.[13]
Glikoliz yo'li
PGni qayta ishlash yo'liga kirish o'rniga GlcN-6-P NagB tomonidan fruktoza-6-fosfatga aylanishi mumkin. Ushbu reaktsiya GlmS fermenti tomonidan qaytariladi,[10][11] amidotransferaza.[13] Keyinchalik ishlab chiqarilgan fruktoza-6-fosfat glikoliz yo'liga kiradi. Glikoliz ishlab chiqarishni katalizlaydi piruvat ga olib boradi limon kislotasining aylanishi va aminokislotalarni ishlab chiqarishga imkon beradi.[14] GlcN-6-P va fruktoza-6-fosfat NagA ning allosterik regulyatorlari vazifasini bajaradi va GlcNAc-6-P ning keyingi deatsetilatsiyasini inhibe qiladi.[15]
Kasallikning dolzarbligi
NagA giyohvand moddalarning potentsial maqsadidir Tuberkulyoz mikobakteriyasi (Mtb). NagA ni yo'q qilishda GlcNAc-6-P allosterik faollashtiruvchisi yuqori darajada hosil bo'ladi,[2] PG-ni qayta ishlash yo'lini davom ettirish uchun GlcN-6-P ishlab chiqarishni oldini oladi. Shuning uchun NagA, Mtbdagi hal qiluvchi metabolik chokepointda,[16] muhim amino-shakar kashshoflarini ishlab chiqarishdagi asosiy fermentativ bosqichni anglatadi. Ushbu prekursorlar Mtb hujayra devori biosintezi uchun talab qilinadi va PGni qayta ishlash yo'liga ta'sir qiladi. Bundan tashqari, MSNagA faol joyida sistein mavjudligi Mtb terapevtikasida noyob ekspluatatsiya maqsadini ko'rsatishi mumkin.[6]
Strukturaviy tadqiqotlar
2019 yil boshidan boshlab, 11 tuzilmalar bilan fermentlarning ushbu klassi uchun hal qilingan PDB qo'shilish kodlari 1O12, 1UN7, 1YMY, 1YRR, 2P50, 2P53, 6FV3, 6FV4, 3EGJ, 3IV8 va 2VHL.
Nomenklatura
Ushbu fermentlar sinfining sistematik nomi N-atsetil-D-glyukozamin-6-fosfat amidohidrolazadir. Umumiy foydalanishdagi boshqa nomlar orasida asetilglukozamin fosfat deatsetilaza, asetilaminodeoksiglukozefosfatatsetilgidrolaza va 2-asetamido-2-deoksi-D-glyukoza-6-fosfat amidohidrolaza mavjud.[15]
Adabiyotlar
- ^ a b "nagA - N-asetilglukozamin-6-fosfat deatsetilaza - Escherichia coli (shtamm K12) - nagA geni va oqsili". www.uniprot.org. Olingan 2019-03-14.
- ^ a b Alvarez-Anorve LI, Bustos-Jaimes I, Calcagno ML, Plumbridge J (oktyabr 2009). "Glyukozamin-6-fosfat deaminaza (NagB) ning allosterik regulyatsiyasi va glyukozaminda ichak tayoqchasining o'sishi". Bakteriologiya jurnali. 191 (20): 6401–7. doi:10.1128 / JB.00633-09. PMC 2753035. PMID 19700525.
- ^ a b v Hall RS, Xiang DF, Xu C, Raushel FM (2007 yil iyul). "N-Asetil-D-glyukozamin-6-fosfat deatsetilaza: bitta ikki valentli metall ioni orqali substratni faollashtirish". Biokimyo. 46 (27): 7942–52. doi:10.1021 / bi700543x. PMC 2533526. PMID 17567047.
- ^ Liu A, Huo L (2014-08-15), John Wiley & Sons Ltd (tahr.), "Amidohidrolaza superfamilasi", eLS, John Wiley & Sons, Ltd, doi:10.1002 / 9780470015902.a0020546.pub2, ISBN 9780470015902
- ^ Yadav V, Panilaitis B, Shi H, Numuta K, Li K, Kaplan DL (2011-06-02). "N-asetilglukozamin 6-fosfat deatsetilaza (nagA) Gluconacetobacter xylinus tarkibidagi N-asetil glyukozaminni o'zlashtirish uchun talab qilinadi". PLOS ONE. 6 (6): e18099. Bibcode:2011PLoSO ... 618099Y. doi:10.1371 / journal.pone.0018099. PMC 3107205. PMID 21655093.
- ^ a b v d e f Ohangar MS, Furze CM, Guy CS, Cooper C, Maskew KS, Graham B, Cameron AD, Fullam E (iyun 2018). "Mycobacterium tuberculosis N-asetilglukozamin-6-fosfat deatsetilaza (NagA)". Biologik kimyo jurnali. 293 (25): 9770–9783. doi:10.1074 / jbc.RA118.002597. PMC 6016474. PMID 29728457.
- ^ a b Ferreira FM, Mendoza-Ernandes G, Kastaneda-Bueno M, Aparisio R, Fischer H, Calcagno ML, Oliva G (iyun 2006). "N-asetilglukozamin-6-fosfat deatsetilaza apoenzimini ichak tayoqchasidan tuzilish tahlili". Molekulyar biologiya jurnali. 359 (2): 308–21. doi:10.1016 / j.jmb.2006.03.024. PMID 16630633.
- ^ Mine S, Kado Y, Vatanabe M, Fukuda Y, Abe Y, Ueda T, Kavarabayasi Y, Inoue T, Ishikava K (Noyabr 2014). "Gipertermofil b-N-asetilglukozaminidaza tuzilishi faol maydon bilan bog'liq yangi dimer arxitekturasini ochib beradi". FEBS jurnali. 281 (22): 5092–103. doi:10.1111 / febs.13049. PMID 25227262. S2CID 21178562.
- ^ a b Vinsent F, Yeyts D, Garman E, Devis GJ, Brannigan JA (2004 yil yanvar). "Bacillus subtilis dan N-asetilglyukozamin-6-fosfat deatsetilaza, NagA ning uch o'lchovli tuzilishi: ureyaza superfamilasining a'zosi". Biologik kimyo jurnali. 279 (4): 2809–16. doi:10.1074 / jbc.M310165200. PMID 14557261.
- ^ a b v Park JT, Uehara T (iyun 2008). "Bakteriyalar o'zlarining ekzoskeletlarini qanday iste'mol qiladilar (peptidoglikan hujayralarining aylanishi va qayta ishlanishi)". Mikrobiologiya va molekulyar biologiya sharhlari. 72 (2): 211-27, tarkib. doi:10.1128 / MMBR.00027-07. PMC 2415748. PMID 18535144.
- ^ a b v Plumbridge J (sentyabr 2009). "Peptidoglikandan N-asetilglyukozaminni qayta ishlashning muqobil yo'li Escherichia coli tarkibidagi N-asetilglukozamin fosfotransferaza tizimini o'z ichiga oladi". Bakteriologiya jurnali. 191 (18): 5641–7. doi:10.1128 / JB.00448-09. PMC 2737974. PMID 19617367.
- ^ Milewski S, Gabriel I, Olchowy J (2006 yil yanvar). "Xamirturushdagi UDP-GlcNAc biosintezi fermentlari". Xamirturush. 23 (1): 1–14. doi:10.1002 / ha.1337. PMID 16408321. S2CID 39940329.
- ^ a b Dhar S, Kumari H, Balasubramanian D, Mathee K (yanvar 2018). "Escherichia coli va Pseudomonas aeruginosa-da hujayra devorlarini qayta ishlash va sintezi - ularning qarshilik rivojlanishidagi roli". Tibbiy mikrobiologiya jurnali. 67 (1): 1–21. doi:10.1099 / jmm.0.000636. PMID 29185941.
- ^ Stryer L, Timoczko JL, Berg JM (2002). "Limon kislotasi tsikli". Biokimyo. 5-nashr.
- ^ a b White RJ, Pasternak CA (1967 yil oktyabr). "N-asetilglukozamin 6-fosfat deatsetilazaning esherichia coli-dan tozalanishi va xususiyatlari". Biokimyoviy jurnal. 105 (1): 121–5. doi:10.1042 / bj1050121. PMC 1198282. PMID 4861885.
- ^ "NagA fermentining molekulyar tushunchalari silga qarshi kurashishda yordam berishi mumkin". News-Medical.net. 2018-07-12. Olingan 2019-03-11.
Qo'shimcha o'qish
- Yamano N, Matsushita Y, Kamada Y, Fujishima S, Arita M (avgust 1996). "N-asetilglyukozamin 6-fosfat deatsetilazni tozalash va V-O1 bo'lmagan Vibrio cholerae ning N-asetilglyukozaminga qarshi faolligi bilan tavsiflash". Bioscience, biotexnologiya va biokimyo. 60 (8): 1320–3. doi:10.1271 / bbb.60.1320. PMID 8987551.


