Skvalen-hopen siklaza - Squalene-hopene cyclase
| Skvalen-hopen siklaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
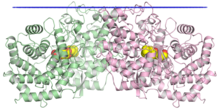 The kristalografik membrana holati ko'k rangda, ikkita monomer yashil va pushti rangda, markaziy bo'shliqda substrat mimetikasi sariq rangda ko'rsatilgan skvalen-hopen siklaza dimerining tuzilishi.[1] | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 5.4.99.17 | ||||||||
| CAS raqami | 76600-69-6 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Skvalen-hopen siklaza (SHK) (EC 5.4.99.17 ) yoki hopan-22-ol gidro-liaza tarkibidagi prokaryotik ferment hisoblanadi terpen siklaza / mutaza oilasi. U atsiklik skvalen molekulasining pentsatsiklik triterpenes hopen va o'zaro konversiyasini katalizlaydi. hopanol 5: 1 nisbatida.[2][3][4][5][6] Ushbu ferment katalizlar quyidagi kimyoviy reaktsiyalar.
- skvalen hop-22 (29) -ene
- skvalen + H2O hopan-22-ol
Skvalen-hopen siklaza muhim ahamiyatga ega, chunki uning mahsulotlari, hopenoidlar, eukariotlar tarkibidagi sterollarga juda o'xshash, chunki ular lipid membranalarini kondensatsiya qiladi va o'tkazuvchanlikni pasaytiradi. Prokariotlar holatida ular qattiq halqa konstruktsiyalari tufayli yuqori harorat va o'ta kislotalik sharoitida barqarorlikni ta'minlaydi.[7] Darhaqiqat, skvalen-hopen siklaza regulyatsiyasi ba'zi bakteriyalarda issiq yoki kislotali muhit ishtirokida sodir bo'ladi.[8][9]

Kirish
Skvalen-hopen siklaza ko'p miqdordagi bakteriyalarda uchraydi, ammo termofil bakteriyadan osonlikcha ajratib olinadi. Alicyclobacillus acidocaldarius.[10] Ning asiklik molekulasining konversiyasini katalizlaydi skvalen ning pentatsiklik triterpenlariga kiradi hopen va hopanol.

Skvalen-hopen siklazasi ko'plab ökaryotik va prokaryotik sinflarning evolyutsion ajdodi deb hisoblanadi. sterol siklazlar.[6] Oksidosqualen siklazalari SHK ning eukaryotik analoglari bo'lgan kislorod reaktsiyasi uchun kislorodni talab qiladi, keyinchalik atmosfera kislorod to'plana boshlagandan so'ng evolyutsiyani namoyish etadi. Gipoksik muhitda skvalen-hopen siklaza funktsiyalari ancha oldin mavjudligini anglatadi.[11]
Tuzilishi
Skvalen-hopen siklaza - bu membrana bilan bog'langan 70-75kDa oqsil bo'lib, 631 ta aminokislotadan va etti marta PTFB takrorlanishidan iborat. U monotopik homodimer sifatida mavjud.[1]
Mexanizm
Gopen skeletining shakllanishi biokimyoda eng murakkab bir bosqichli reaktsiyalardan biridir.[12] Bir qadamda 13 kovalent bog'lanish uziladi yoki hosil bo'ladi, 9 ta chiral markazlari tashkil etiladi va 5 ta halqa hosil bo'ladi.[13] Skvalen-hopen siklaza skvalenning asiklik molekulasining hopen va hopanolning pentatsiklik triterpenlariga aylanishini katalizlaydi. Ushbu mahsulotlar 5: 1 nisbatida paydo bo'ladi. Hopen sintezi kafedraning barcha konformatsiyasida bog'laydigan skualen bilan boshlanadi va undan keyin beshta C-C bog'lanish hosil bo'ladi.[14] Ushbu ketma-ket halqa hosil qiluvchi reaksiya bosqichlari ikki terminal qo'shaloq bog'lanishning biriga kislotali protonning elektrofil hujumi bilan boshlanadi. Suvli molekula tomonidan qabul qilinishi bilan skvalenning muqobil terminal metil guruhidan proton chiqarilganda politsiklik shakllanish tugaydi.[5] Ushbu baza sifatida tanilgan oldingi suv. Boshqa suv molekulalari qutblanishni kuchaytirish uchun ishlaydi (orqa suvlar) va qurish vodorod aloqalari etti qoldiq orasida - T41, E45, E93, R127, Q262, W133 va Y267. Old suv ham oxirgi mahsulotni aniqlashda rol o'ynaydi. Agar u metilen guruhidan hosil bo'lgan protonni saqlasa 29 yoki 30 gopen hosil qilish uchun. Ammo protonni qabul qilish o'rniga suv A-halqaning C-22 kationiga gidroksilni qo'shsa, hopanol kamroq miqdorda ishlab chiqariladi.[15]

A dan D gacha uzuklar hosil bo'lishida konformatsion o'zgarishlar juda kam bo'ladi. Shuning uchun reaktsiya oraliqni talab qilmaydi va bir bosqichda amalga oshishi mumkin. Biroq, halqa E hosil bo'lishiga to'sqinlik qiladi entropik to'siq, bu uning tetratsiklda yo'qligini tushuntirishi mumkin steroidlar.[5]
Faol sayt
SHK faol sayt membranaga ulashgan oqsil mintaqasi ichidagi markaziy bo'shliqda joylashgan bo'lib, unga qutb bo'lmagan kanal orqali substrat orqali erishiladi.[16] Faol joy, xususan, aromatik qoldiqlar bilan o'ralgan bo'lib, ular konvalga o'ralgan holda skvalen molekulasiga bemalol mos keladi. The katalitik mexanizm qo'shib ishlatadi aspartat va histidin boshlash uchun qoldiqlar siklizatsiya tomonidan reaktsiya protonatsion C3 da va C29 da deprotonatsiyalash, diskret qatorlar orqali o'tishi karbokatsiya oraliq mahsulotlar.[1][17] Fermentni katalitik aspartatlarning mutatsiyasi bilan inaktiv qilish mumkin.[18]
Termodinamika
Ushbu ferment odatdagidan farq qiladi ekzotermik 40-50 kkal / mol energiya chiqarishi bilan, proteinni barqarorlashtirish energiyasidan ancha yuqori. Bu katta mahsulot chiqadigan lipidli yon kanalni eritadi deb o'ylashadi. Uning tarkibiy yaxlitligini saqlab qolish uchun ba'zi olimlar fermentning 7-8 tandem bo'lmagan takroriy QW motiflarini (Q glutamin va V triptofan ) ko'p sonli sirtni birlashtirgan a spirallari protein tarkibini torting va denaturatsiyani oldini oling.[1]

Adabiyotlar
- ^ a b v d Wendt KU, Poralla K, Schulz GE (1997 yil sentyabr). "Skvalen siklaza tuzilishi va funktsiyasi". Ilm-fan. 277 (5333): 1811–5. doi:10.1126 / science.277.5333.1811. PMID 9295270.
- ^ Xoshino T, Sato T (2002 yil fevral). "Skvalen-hopen siklaza: katalitik mexanizm va substratni aniqlash". Kimyoviy aloqa (4): 291–301. doi:10.1039 / b108995c. PMID 12120044.
- ^ Xoshino T, Nakano S, Kondo T, Sato T, Miyoshi A (2004 yil may). "Skvalen-hopen siklaza: yakuniy deprotonatsiya reaktsiyasi, (3R, S) -2,3-oksidosqualenning tsikliga konformatsion tahlili va izopropiliden qismi politsiklizatsiya kaskadini boshlash uchun ham, uning hosil bo'lishi uchun ham zarurligini tasdiqlovchi boshqa dalillar. 5 kishilik elektron halqa ". Organik va biomolekulyar kimyo. 2 (10): 1456–70. doi:10.1039 / b401172d. PMID 15136801.
- ^ Sato T, Kouda M, Hoshino T (2004 yil mart). "Alicyclobacillus acidocaldarius dan skualen-hopen siklazaning deprotonatsiya qilinadigan joyida saytga yo'naltirilgan mutagenez tajribalari". Bioscience, biotexnologiya va biokimyo. 68 (3): 728–38. doi:10.1271 / bbb.68.728. PMID 15056909.
- ^ a b v Reinert DJ, Balliano G, Schulz GE (2004 yil yanvar). "Skvalenning pentakarbotsiklik gopenga aylanishi". Kimyo va biologiya. 11 (1): 121–6. doi:10.1016 / j.chembiol.2003.12.013. PMID 15113001.
- ^ a b Pearson A, Budin M, Brocks JJ (2003 yil dekabr). "Gemmata obscuriglobus bakteriyasida sterol sintezining filogenetik va biokimyoviy dalillari". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 100 (26): 15352–7. doi:10.1073 / pnas.2536559100. PMC 307571. PMID 14660793.
- ^ Kannenberg, E .; Poralla, K. (1999). "Gopanoid biosintezi va bakteriyalardagi funktsiyasi". Naturwissenschaften. 86 (4): 168–176. doi:10.1007 / s001140050592.
- ^ Ourisson G, Rohmer M, Poralla K (1987). "Prokaryotik gopanoidlar va boshqa polterpenoid sterol surrogatlar". Mikrobiologiyaning yillik sharhi. 41: 301–33. doi:10.1146 / annurev.mi.41.100187.001505. PMID 3120639.
- ^ Sahm H, Rohmer M, Bringer-Meyer S, Sprenger GA, Velle R (1993). "Bakteriyalardagi hopanoidlarning biokimyosi va fiziologiyasi". Mikrobial fiziologiyaning yutuqlari. 35: 247–73. doi:10.1016 / s0065-2911 (08) 60100-9. ISBN 9780120277353. PMID 8310881.
- ^ Sekler B.; Poralla, K. (1986). "Skvalen-hopen siklazaning Bacillus acidocaldarius dan xarakteristikasi va qisman tozalanishi". Biochimica et Biofhysica Acta (BBA) - Umumiy mavzular. 881 (3): 356–363. doi:10.1016/0304-4165(86)90027-9.
- ^ Rohmer, M .; Bovye, G.; Ourisson, G. (1979). "Biyomembranlarning molekulyar evolyutsiyasi: sterollarning strukturaviy ekvivalentlari va filogenetik prekursorlari". Milliy fanlar akademiyasi materiallari. 76 (2): 847–851. doi:10.1073 / pnas.76.2.847. PMC 383070. PMID 284408.
- ^ Siedenburg G, Jendrossek D (iyun 2011). "Skvalen-hopen siklazlari". Amaliy va atrof-muhit mikrobiologiyasi. 77 (12): 3905–15. doi:10.1128 / aem.00300-11. PMC 3131620. PMID 21531832.
- ^ Corey EJ, Matsuda SP, Bartel B (dekabr 1993). "Tsikloartenol sintazni kodlovchi arabidopsis taliana genini xromatografik ekran yordamida lanosterol sintazga ega bo'lmagan xamirturush mutantida funktsional ekspresiya bilan ajratish". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 90 (24): 11628–32. doi:10.1073 / pnas.90.24.11628. PMC 48037. PMID 7505443.
- ^ Zheng YF, Abe I, Prestvich GD (aprel 1998). "Bakterial skvalenning inhibisyon kinetikasi va yaqinligini belgilash: 2,3-oksidosqualenning tia bilan almashtirilgan analoglari bilan hopen siklaza". Biokimyo. 37 (17): 5981–7. doi:10.1021 / bi9727343. PMID 9558334.
- ^ [1]
- ^ Gao Y, Honzatko RB, Peters RJ (oktyabr 2012). "Terpenoid sintaz tuzilmalari: murakkab katalizning hozirgacha to'liq bo'lmagan ko'rinishi". Tabiiy mahsulotlar haqida hisobotlar. 29 (10): 1153–75. doi:10.1039 / C2NP20059G. PMC 3448952. PMID 22907771.
- ^ Xoshino T, Sato T (2002 yil fevral). "Skvalen-hopen siklaza: katalitik mexanizm va substratni aniqlash". Kimyoviy aloqa (4): 291–301. doi:10.1039 / B108995C. PMID 12120044.
- ^ Feyl, C .; Sussmut R.; Jung, G.; va boshq. (1996). "Skualen-hopen siklazdagi faol joy qoldiqlarining saytga yo'naltirilgan mutagenezi". Evropa biokimyo jurnali. 242 (1): 51–55. doi:10.1111 / j.1432-1033.1996.0051r.x. PMID 8954152.
Tashqi havolalar
- Skvalen-hopen + siklaza AQSh Milliy tibbiyot kutubxonasida Tibbiy mavzu sarlavhalari (MeSH)

