Glutamik proteaz - Glutamic protease - Wikipedia
| Skitalidopepsin B | |||||||
|---|---|---|---|---|---|---|---|
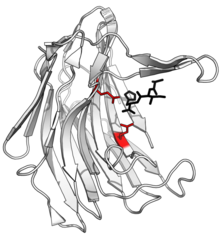 Tarkibi skalidokarboksil peptidaza B, ajratilgan peptid bilan mahsulot qora va faol sayt qizil rangli glutamat-glutamin dyad yon zanjirlari. (PDB: 1S2K) | |||||||
| Identifikatorlar | |||||||
| Organizm | |||||||
| Belgilar | Yo'q | ||||||
| PDB | 1S2K | ||||||
| UniProt | P15369 | ||||||
| Boshqa ma'lumotlar | |||||||
| EC raqami | 3.4.23.32 | ||||||
| |||||||
Glutamik proteazlar guruhidir proteolitik fermentlar o'z ichiga olgan glutamik kislota faol sayt ichida qoldiq. Ushbu turdagi proteaz birinchi marta 2004 yilda tavsiflangan va proteazning oltinchi katalitik turiga aylangan.[1] Ushbu proteaz guruhining a'zolari ilgari an aspartat proteaz, ammo tarkibiy aniqlik uni yangi proteazlar oilasiga mansubligini ko'rsatdi. Ushbu proteaz guruhining birinchi tuzilishi edi sitalidoglutamik peptidaza, faol joyida katalitik dyad, glutamik kislota (E) va glutamin (Q) mavjud bo'lib, bu nom paydo bo'lishiga olib keladi. eqolisin. Ushbu proteazlar guruhi asosan o'simlik va odamga ta'sir qiluvchi patogen zamburug'larda uchraydi.[2]
Tarqatish va turlari
Ikkita mustaqil oilalar glutamik proteazlar (G1 va G2) va cheklangan tarqalishiga ega. Dastlab ular cheklangan deb o'ylashgan filamentli qo'ziqorinlar asosan Ascomycota filum.[3] Ammo keyinchalik glutamik proteazlar aniqlangan bakteriyalar va arxey.[4]
Qo'ziqorinlarda glutamik proteazalarning birinchi superfamiliyasi aniqlandi Scytalidium lignikola va Aspergillus niger var. makrosporus, undan sitalidoglutamik peptidaza (eqolisin) va aspergilloglutamik peptidaza navbati bilan olingan. Ushbu ikkita proteaz tarkibida Glu va Gln faol joylari mavjud va ular MEROPS ostida guruhlangan oila G1.[5][6]
Birgalikda rivojlangan glutamik peptidaza, bo'yin oldidagi oqsil (bakteriyofag phi-29) faol joyda Glu va Asp dyadidan foydalanadi va MEROPS oilasi G2 deb tasniflanadi.[7]
Xususiyatlari
Ushbu fermentlar kislota proteazalari; eqolisin masalan, kazein substrat sifatida ishlatilganda pH 2.0 da eng faol bo'ladi.[2] Ekolosinlar P1 uchastkasida katta miqdordagi aminokislota qoldiqlarini va P1 ′ uchastkasida kichik aminokislotalar qoldiqlarini afzal ko'rishadi. Proteazning o'ziga xos xususiyati uning befarqligidir pepstatin va S-PI (atsetil pepstatin) va u ilgari "pepstatinga sezgir bo'lmagan karboksil proteinazalar" deb tasniflangan.[8] Boshqa "pepstatinga befarq karboksil proteinazlar" ning subfamilyasiga tegishli serin proteaz, serin-karboksil proteaz (sedolisin) 2001 yilda topilgan.[2] Ushbu proteazlar DAN (diazoatsetil-DL-norleucine methylester) tomonidan inhibe qilinmaydi [7], ammo EPNP (1,2-epoksi-3- (p-nitrofenoksiya) propan).[9][10]
Katalizning faol joyi va mexanizmi
The faol sayt eqolosinning o'ziga xos xususiyati mavjud glutamik kislota va glutamin substratni bog'lash va kataliz qilishda ishtirok etadigan katalitik dyad. Ushbu qoldiqlar nukleofil rolini o'ynaydi, glutamik kislota reaktsiyaning birinchi bosqichida umumiy kislota bo'lib xizmat qiladi va substratning peptid bog'lanishidagi karbonil kislorodga proton beradi. Bir yoki ikkita suv molekulasi gidroksil guruhini etkazib beradigan reaktsiyaga kirishi mumkin va glutamik kislota amid azotiga protonni qo'shimcha ravishda beradi, natijada peptid aloqasi uziladi. Keyin glutamin glutamik kislotani dastlabki holatiga qaytaradi.[11]
Shuningdek qarang
Adabiyotlar
- ^ Fujinaga M, Cherney MM, Oyama H, Oda K, Jeyms MN (Mar 2004). "Scytalidium lignicolum yangi karboksil peptidazasining molekulyar tuzilishi va katalitik mexanizmi". Amerika Qo'shma Shtatlari Milliy Fanlar Akademiyasi materiallari. 101 (10): 3364–9. doi:10.1073 / pnas.0400246101. PMC 373467. PMID 14993599.
- ^ a b v Oda K (yanvar 2012). "Karboksil peptidazalarning yangi oilalari: serin-karboksil peptidazalar va glutamik peptidazalar". Biokimyo jurnali. 151 (1): 13–25. doi:10.1093 / jb / mvr129. PMID 22016395.
- ^ Sims AH, Dunn-Coleman NS, Robson GD, Oliver SG (2004 yil oktyabr). "Glutamik proteazning tarqalishi filamentli zamburug'lar bilan cheklangan". FEMS mikrobiologiya xatlari. 239 (1): 95–101. doi:10.1016 / j.femsle.2004.08.023. PMID 15451106.
- ^ Jensen K, Ostergaard PR, Wilting R, Lassen SF (2010). "Bakterial glutamik peptidazani aniqlash va tavsifi". BMC Biokimyo. 11 (47): 47. doi:10.1186/1471-2091-11-47. PMC 3009609. PMID 21122090.
- ^ Sasaki H, Kubota K, Li WC, Ohtsuka J, Kojima M, Ivata S, Nakagava A, Takahashi K, Tanokura M (iyul 2012). "Avtoproteoliz natijasida hosil bo'lgan fermentlarni faollashtiradigan mahsulot kompleksini taqlid qiluvchi aspergilloglutamik peptidazning oraliq dimerining kristalli tuzilishi". Biokimyo jurnali. 152 (1): 45–52. doi:10.1093 / jb / mvs050. PMID 22569035.
- ^ Takahashi K (2013). "Katalitik karboksil guruhi (lar) bilan fermentlarni tuzilishi va funktsiyasini o'rganish: ribonukleaz T1 dan karboksil peptidazalargacha". Yaponiya akademiyasi materiallari, B seriyasi. 89 (6): 201–25. doi:10.2183 / pjab.89.201. PMC 3749792. PMID 23759941.
- ^ "G2 oilasi". MEROPS.
- ^ "G1 oilasi". MEROPS.
- ^ Murao S, Oda K, Matsushita Y (1973). "Streptomitsis bo'lmagan pepsin inhibitori va N-diazoatsetil-DL-norleusin metilesterga sezgir kislota proteazalarini ishlab chiqaradigan mikroorganizmni ajratish va identifikatsiyalash". Agric. Biol. Kimyoviy. 37 (6): 1417–1421. doi:10.1271 / bbb1961.37.1417.
- ^ Morihara K, Tsuzuki H, Murao S, Oda K (Mar 1979). "Scytalidium lignicolum dan pepstatin-insensiv kislota proteazalari. Sintetik peptidlar bilan kinetik o'rganish". Biokimyo jurnali. 85 (3): 661–8. PMID 34596.
- ^ Moselio Schaechter, tahrir. (2009). Mikrobiologiya entsiklopediyasi (3-nashr). Akademik matbuot. p. 499. ISBN 978-0123739391.

